 Il 6 marzo del 1869, dopo circa tre mesi di lavoro quasi ossessivo, un professore di Chimica dell’Università di San Pietroburgo, Dmitrij Ivanovic Mendeleev, pubblicò un primo abbozzo della tavola periodica degli elementi. Non sappiamo se Mendeleev fosse un rivoluzionario o quali fossero le sue idee politiche. In quegli anni essere un chimico non sembrava andare d’accordo con la rivoluzione visto che, qualche anno prima, il papà della Chimica Antoine Lavoisier (autore della legge di conservazione della massa) era stato decapitato da un tribunale rivoluzionario francese.
Il 6 marzo del 1869, dopo circa tre mesi di lavoro quasi ossessivo, un professore di Chimica dell’Università di San Pietroburgo, Dmitrij Ivanovic Mendeleev, pubblicò un primo abbozzo della tavola periodica degli elementi. Non sappiamo se Mendeleev fosse un rivoluzionario o quali fossero le sue idee politiche. In quegli anni essere un chimico non sembrava andare d’accordo con la rivoluzione visto che, qualche anno prima, il papà della Chimica Antoine Lavoisier (autore della legge di conservazione della massa) era stato decapitato da un tribunale rivoluzionario francese.
Si sapeva, o meglio alcuni sapevano, che la materia è tutto ciò che ci circonda. Quindi non esiste nessun misterioso etere sulla terra ma semplicemente materia. Qualcuno di questi materiali, ad esempio l’oro e il ferro, erano noti dall’antichità. Altri elementi erano già stati scoperti e studiati.
Oggi sappiamo che quegli elementi sono formati da particelle piccolissime chiamate atomi. Ma, in quei tempi si considerava l’atomo come indivisibile e nessuno sapeva bene cosa era.
Molta della chimica di quegli anni si basava su prove sperimentali. Alcuni elementi si comportavano in un modo, altri in modo diverso. E poi si riuscivano a pesare quando si combinavano a formare altri materiali. Fu proprio il peso a guidare Mendeleev in una combinazione che provava a classificare gli elementi conosciuti.
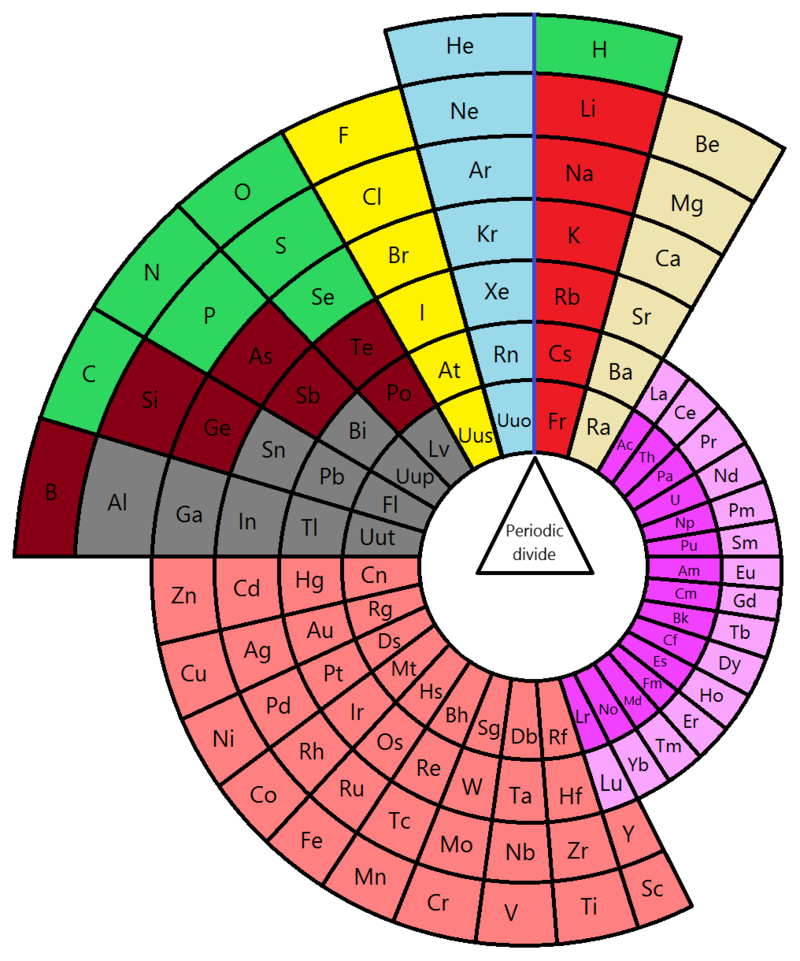
La genialità di Mendeleev, in genere, si racconta in questo modo: capì che gli elementi conosciuti erano troppo pochi e studiò una tabella in cui lasciò molte caselle vuote. A chi storceva il naso, rispose che si sarebbero scoperti altri elementi. Aveva ragione.
Oggi la tavola periodica consta di 118 elementi. Alcuni naturali, altri artificiali. Gli ultimi scoperti sono, in realtà, delle curiosità. Ottenuti artificialmente durano un istante e poi si trasformano in altri elementi. Dei più di cento elementi alcuni si trovano ovunque (carbonio, azoto, ossigeno, idrogeno etc…), altri sono rarissimi e quasi nessuno li ha mai visti davvero su un bancone da laboratorio.
Dove si trovano e come si trovano? Alcuni, molto pochi in realtà, si trovano anche da soli come elementi. La maggior parte è combinata con altri elementi nelle rocce, nell’aria, nel mare e nei fiumi, negli animali e nei vegetali. Tutto insomma ciò che serve a fare qualsiasi cosa è lì in quella tavola. Sono i mattoncini con cui è fatto tutto ciò che esiste.
Che questi mattoncini siano costituiti da atomi oggi è indispensabile saperlo anche per interpretare la tavola ma Mendeleev non lo sapeva affatto. Oggi, non sono ordinati per peso come aveva fatto il chimico russo ma per numero atomico. Questo perché gli atomi non sono per nulla indivisibili e sono formati da almeno tre particelle subatomiche che si chiamano protoni, neutroni ed elettroni. I più importanti sono gli ultimi ma la classificazione si fa sui protoni. Il Ferro, ad esempio ha 26 protoni e sta nella tavola a quel numero. L’idrogeno precede tutti col numero 1, l’uranio sta quasi in fondo con il 92.
Questo non significa affatto che il ferro è 26 volte più pesante dell’idrogeno e che,a sua volta, l’uranio è ancora tre volte più grande. Perché ci sono i neutroni che rendono ancora tutto più complicato. Ad esempio vi è un idrogeno che pesa 1 e un uranio che pesa 238. Ma vi sono almeno tre idrogeni diversi che pesano il doppio e il triplo dell’idrogeno più comune.
Gli elettroni invece, sarebbero come i protoni ma in realtà vanno e vengono. C’è chi li perde volentieri come i metalli, c’è chi li acquista come i non metalli. E poi c’è qualcuno che li perde ma a volte li acquista e sono i semimetalli.
E qui c’è una seconda cosa geniale nella tavola periodica. Mendeleev, gli elementi li ha ordinati in colonne verticali e righe orizzontali. Le seconde si chiamano periodi e sono sette (sembrano nove ma le ultime due sono da inserire nel sesto e nel settimo come inserti). I periodi sono una magia: gli elettroni non erano conosciuti ma in realtà stanno in sette livelli di orbitali intorno a una parte centrale che si chiama nucleo dell’atomo. E ogni periodo di Mendeleev oggi viene spiegato come corrispondente a un livello elettronico. All’inizio, partendo da sinistra, gli elementi sono tutti metalli (sono solidi, si lavorano facilmente, conducono calore ed elettricità, sono di aspetto lucente). Andando verso destra sono quasi uguali a quelli prima ma hanno un protone e un elettrone in più. A poco a poco, si aggiungono particelle e sono sempre meno metalli, anzi diventano semimetalli e poi non metalli. La quantità si trasforma in qualità non solo nella dialettica filosofica ma in tutto ciò che ci circonda. Basta aggiungere una particella piccolissima e i semimetalli diventano elementi che non si lavorano bene, non conducono, sono opachi, sono a volte solidi, liquidi o gassosi e si chiamano non metalli. A loro volta, con poche particelle in più i non metalli diventano gas nobili a cui non importa nulla di legarsi con altri (e per questo si chiamano così). Ma è tutto ciclico e basta un protone in più per avere un metallo ancora più metallo del suo predecessore nel livello superiore. Mendeleev non aveva letto né Hegel né i suoi critici da sinistra come Engels o Marx ma un esempio fenomenale di una legge sulla dialettica materialista della natura ce lo ha fornito eccome.
La tavola periodica, se letta nel suo insieme ci fornisce un esempio totalizzante. La materia è tutta li dentro. Sono dentro l’aria che respiriamo con l’ossigeno e l’azoto i cui atomi devono sempre stare in coppia, è dentro il mare con l’acqua e i suoi due atomi di idrogeno e di ossigeno che sciolgono un sacco di sali in cui a farla da padrone sono il sodio e il cloro. Ma ci sono dentro soprattutto le rocce e tutta la crosta terrestre con i suoi metalli. L’impressione, studiandola, è quella di poter comprendere tutto ciò che ci circonda e tutto ciò che accade dentro di noi con i nostri muscoli, il cervello e le reazioni che ci fanno sognare, disperare e gioire.
Agli inizi del novecento però Heisenberg e altri complicano la comprensione ai cultori della materia e poi ai filosofi. Gli elettroni che Mendeleev non conosceva erano stati posizionati su orbite ben precise e su livelli a distanza ben stabilita dal nucleo. Di loro si pretendeva di sapere tutto, il loro numero, la loro posizione e la loro velocità. Ma erano troppo piccoli e Heisenberg con il suo principio di indeterminazione stabilì che per corpi così minuscoli non era possibile determinare esattamente posizione e velocità. Questa teoria così determinante a livello subatomico era però una teoria generale. Se valeva per l’elettrone non poteva non valere per corpi con maggiore massa.
Queste scoperte furono l’alimento per una nuova crociata contro la pretesa di conoscere tutto della materia. Ma in realtà ci dicono solo che non è così semplice come si poteva credere e che scoperta una cosa poi se ne scopre un’altra ma la validità delle scoperte precedenti non perde la sua importanza. Forse non sapremo esattamente dove stanno gli elettroni, le orbite sono diventate i più astratti orbitali ma quando scaldiamo un atomo di sodio la fiamma diventa gialla perché gli elettroni saltano da un livello all’altro e tornano indietro emettendo quelle specifiche radiazioni. Forse non saltano esattamente come la pensavano solo 10 anni prima ma quella luce continua ad essere un elemento materiale e non metafisico. Non è un miracolo e il principio di Heisenberg non richiede affatto nessun Dio per essere spiegato.
Unendo l’elemento che sta al posto 26 che si chiama ferro e l’elemento che sta al 17 che si chiama cloro si ottiene un sale binario di colore rosso scuro. Sciolto in acqua in grande concentrazione si ottiene un liquido scuro che tende a divenire semisolido. Ma in caso di agitazione ripetuta si liquefa nuovamente. E’ questo che accade quando due elementi della tavola di Mendeleev si mettono insieme con quella combinazione. E’ un sale binario, sembra sangue ma non lo è. Neppure quello di San Gennaro.
Collettivo Comunista Genova City Strike-NST
